АТОМНЫЕ СПЕКТРЫ
спектры
А. с. возникают при переходах
Линии А. с. образуют закономерные
где n Жёлтая линия в спектре атома
(см. Атом, рис. 1,6). Значение
Спектры атомов щелочных металлов,
Для атомов с двумя или неск.
Систематика спектров атомов
Кроме тонкой структуры, в
В А. с. проявляются не все
Количественной характеристикой
Наряду с изучением А. с.
Исследование А. с. сыграло
Лит.: Шпольский Э. В., Атомная
М.- Л., 1963; Ельяшевич М.
А
Б
В
Г
Д
Е
Ё
Ж
З
И
Й
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Ш
Щ
Ъ
Ы
Ь
Э
Ю
Я
оптические, получающиеся при испускании или поглощении света (электромагнитных
волн) свободными или слабо связанными атомами; такими спектрами обладают,
в частности, одноатомные газы и пары. А. с. являются л и н е й ч ат ы м
и - они состоят из отдельных с п е к т р а л ь н ы х л и н и й . А. с.
наблюдаются в виде ярких цветных линий при свечении газов или паров в электрич.
дуге или разряде (спектры испускания) и в виде тёмных линий (спектров поглощения).
Каждая спектральная линия характеризуется определённой частотой колебаний
v испускаемого или поглощаемого света и соответствует определённому квантовому
переходу между уровнями энергии Et и Еи атома согласно соотношению: hv=
Et - Eh, где h - Планка постоянная). Наряду с частотой спектральную линию
можно характеризовать длиной волны X=c/v, волновым числом 1/
между уровнями энергии внешних электронов атома и наблюдаются в видимой,
ультрафиолетовой и близкой инфракрасной областях. Такими спектрами обладают
как нейтральные, так и ионизованные атомы; их часто наз. соответственно
дуговыми и искровыми спектрами (нейтральные атомы легко возбуждаются и
дают спектры испускания в электрич. дугах, а положит. ионы возбуждаются
труднее и дают спектры испускания преим. в искровых электрич. разрядах).
Спектры ионизованных атомов смещены по отношению к спектрам нейтральных
атомов в область больших частот, т. е. в ультрафиолетовую область. Это
смещение тем больше, чем выше кратность ионизации атома - чем больше электронов
он потерял. Спектры нейтрального атома и его последовательных ионов обозначают
в спектроскопии цифрами I, II, III, ... В реально наблюдаемых спектрах
часто присутствуют одновременно линии нейтрального и ионизованных атомов;
так говорят, напр., о линиях Fel, Fell, Felll в спектре железа, соответствующих
Fe, Fe+, Fe2+.
группы, наз. с п е к т р а л ь н ы м и с е р и я м и. Промежутки между
линиями в серии убывают в сторону коротких длин волн, и линии сходятся
к г р ан и ц е с е р и и. Наиболее прост спектр атома водорода. Волновые
числа линий его спектра с огромной точностью определяются формулой Бальмера:
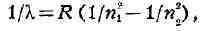
происходит квантовый переход

Na (дублет X = 5690 А и X =5696 А).
ni = l, 2, 3, ... определяет серию, а значение n
области спектра, при n
увеличенным в Z2 раз масштабом (Z - атомный номер), обладают
водородоподобные ионы Не+, 1i2+, ...(спектры Hell,
Lilll,...).
обладающих одним внешним (оптическим) электроном помимо заполненных оболочек,
схожи со спектром атома водорода, но смещены в область меньших частот;
число спектральных серий увеличивается, а закономерности в расположении
линий усложняются. Пример - спектр Na, атом которого обладает нормальной
электронной конфигурацией Is2 2s2 2p6
3s (см. в ст. Атом - Заполнение электронных оболочек и слоев) с легко возбуждаемым
внешним электроном 3s; переходу этого электрона из состояния 3s в состояние
Зр соответствует жёлтая линия Na (д у б л ет X, = 5690А и Х.=569бА; см.
рис.), с к-рой начинается т. н. г л а в н а я
с е р и я N a, члены к-рой соответствуют переходам между состоянием 3s
и состояниями Зр, 4р, 5р,...; граница серии соответствует ионизации атома
Na.
внешними электронами спектры значительно усложняются, что обусловлено взаимодействием
электронов. А. с. особенно сложны для атомов с заполняющимися а- и f-оболочками;
число линий доходит до многих тысяч, и уже нельзя обнаружить простых серий,
аналогичных сериям в спектрах водорода и щелочных металлов. Однако и в
сложных спектрах можно установить определённые закономерности в расположении
линий, произвести систематику спектра и определить схему уровней энергии.
с двумя или более внешними электронами основана на приближённой характеристике
отдельных электронов при помощи квантовых чисел п и L (см. Атом) с учётом
взаимодействия этих электронов друг с другом. При этом приходится учитывать
электростатич. взаимодействия электронов - отталкивание по закону Кулона,
и магнитные взаимодействия спиновых и орбитальных моментов (см. Спин, Спин-орбитальное
взаимодействие), к-рые приводят к тонкому расщеплению уровней энергии (см.
Тонкая структура). Благодаря этому у большинства атомов спектральные линии
представляют собой более или менее тесную группу линий, называемую мультиплетом.
Так, у всех щелочных металлов линии двойные (д у б-л е т ы), причём расстояния
между мультиплетными уровнями увеличиваются с увеличением атомного номера
элемента. У щёлочноземельных элементов наблюдаются одиночные линии (сингулеты)
и тройные (т р и п л е т ы). Спектры следующих столбцов таблицы Менделеева
образуют всё более сложные мультипле-ты, причём нечётным столбцам соответствуют
чётные мультиплеты, а чётным столбцам - нечётные.
А. с. наблюдается сверхтонкая структура, обусловленная магнитными моментами
ядер. Сверхтонкая структура по порядку величины в 1000 раз уже обычной
муль-типлетной структуры и исследуется методами радиоспектроскопии.
переходы между уровнями энергии данного атома или иона, а лишь вполне определённые,
допускаемые (разрешённые) т. н. отбора правилами, зависящими от характеристик
уровней энергии. В случае одного внешнего электрона возможны лишь переходы,
для к-рых азимутальное квантовое число / увеличивается или уменьшается
на 1; правило отбора имеет вид: дl = ±1. В результате s-уровни (l=0) комбинируют
с р-уровня-ми (L = 1), р-уровни -с d-уровнями (L = 2) и т. д., что определяет
возможные спектральные серии для атомов щелочных металлов, частный случай
которых представляет главная серия Na (переходы 3s>np, где n=3, 4, 5,...);
другие переходы этим правилом отбора запрещены. Для многоэлектронных атомов
правила отбора имеют более сложный пил.
разрешённого оптич. перехода является его в е р о я т н о с т ь (см. Вероятность
перехода), определяющая, как часто этот переход может происходить; вероятность
запрещённых переходов равна нулю. От вероятностей переходов зависят и н
т е н с и в н о с т и спектральных линий. В простейших случаях вероятности
переходов для А. с. могут быть рассчитаны по методам квантовой механики.
для свободных атомов значительный интерес представляет исследование изменений
в А. с. при внешних воздействиях на атомы. Под действием внешнего магнитного
или электрич. поля происходит расщепление уровней энергии атома и соответствующее
расщепление спектральных линий (см. Зеемана явление я Штарка явление).
важную роль в развитии представлений о строении атома (см. Атомная физика).
Методы, основанные на изучении А. с., очень широко распространены в различных
областях науки и техники. А. с. позволяют определить ряд весьма важных
характеристик атомов и получить ценные сведения о строении электронных
оболочек атома. Чрезвычайно существенно применение А. с. в эмиссионном
спектральном анализе (по А. с. испускания), к-рый благодаря высокой чувствительности,
быстроте и универсальности завоевал прочное место в металлургии, горнорудной
пром-сти, машиностроении и во многих др. отраслях нар. х-ва; наряду с эмиссионным
спектральным анализом успешно применяют и абсорбционный спектральный анализ
(по А. с. поглощения).
физика, 5 изд.. т. 1, М., 1963, т. 2, М.. 195U ф р и ш С. Э., Оптические
спектры атомов"
А., Атомная и молекулярная спектроскопия, М., 1962. М. А. Ельяшевич.