Электронные оболочка сложных
атомов.
Теория сложных А., содержащих 2 или более электронов, принципиально отличается
от теории А. водорода, т. к. в сложном А. имеются в з а и м од е й с т
в у ю щ и е друг с другом одинаковые частицы - электроны. Взаимное отталкивание
электронов в многоэлектроином А. существенно уменьшает прочность их связи
с ядром. Напр., энергия отрыва единственного электрона в ионе гелия (Не+)
равна 54,4 эв; в нейтральном же атоме гелия в результате отталкивания электронов
энергия отрыва одного из них уменьшается до 24,6 эв. Для внешних электронов
более тяжёлых А. уменьшение прочности их связи из-за отталкивания внутренними
электронами ещё более значительно. Чрезвычайно важную роль в сложных А.
играют свойства электронов как одинаковых микрочастиц (см. Тождественности
принцип), обладающих спином s = 1/2, для к-рых справедлив Паули
принцип. Согласно этому принципу, в системе электронов не может быть более
одного электрона в каждом квантовом состоянии, что для сложного А. приводит
к образованию электронных оболочек, заполняющихся строго определёнными
числами электронов.
Учитывая неразличимость взаимодействующих
З а п о л н е н и е э л е
Наиболее близко к ядру расположен
Рис. 5. Последовательность
Чем слабее связан электрон
Такие же электронные
При рассмотрении заполнения
А
Б
В
Г
Д
Е
Ё
Ж
З
И
Й
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Ш
Щ
Ъ
Ы
Ь
Э
Ю
Я
между собой электронов, имеет смысл говорить только о квантовых состояниях
А. в целом. Однако приближённо можно рассматривать квантовые состояния
отдельных электронов и характеризовать каждый из них совокупностью четырёх
квантовых чисел п, I, m
от п, как в А. водорода, но и от l; от m
энергию и образуют определённую э л е к тр о н н у ю о б о л о ч к у; их
называют э к в и в а л е н т н ы м и электронами. Такие электроны и образованные
ими оболочки обозначают, как и квантовые состояния и уровни энергии с заданными
n и /, символами ns, np, nd, nf, ... (для l=0, 1, 2, 3, ...) и говорят
о 2р-электро-нах, Ss-оболочках и т. п.
к т р о н н ы х о б о л о ч е к и с л о е в. В силу принципа Паули любые
2 электрона в А. должны находиться в различных квантовых состояниях и,
следовательно, отличаться хотя бы одним из четырёх квантовых чисел n<,
l, mi и т
n и l, т. е. степени вырождения его уровня энергии. Это число gi = 2 (2l
+1) = <=2, 6, 10, 14, ... и определяет число электронов, полностью
заполняющих данную оболочку. Т. о., s-, p-, d-, f-, ... оболочки заполняются
2, 6, 10, 14, ... электронами, независимо от значения n. Электроны с данным
n образуют слой, состоящий из оболочек с l=0, 1, 2, ..., п-1 и заполняемый
2п2 электронами, т. н. К-, L-, М-, N-, ...слой. При полном заполнении
имеем:
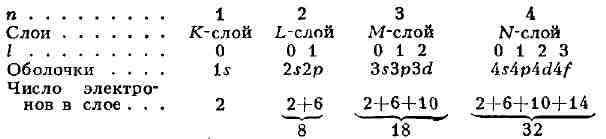
1C-слой, затем идёт L-слой, М-слой, N-слой, ... В каждом слое оболочки
с меньшими l характеризуются большей электронной плотностью вблизи ядра.
Прочность связи электрона уменьшается с увеличением n, а при заданном n
- с увеличением l; на рис. 5 схематически показаны (без соблюдения масштаба
энергий) уровни энергии отдельного электрона в сложном А.

заполнения уровней энергии отдельного электрона в сложном атоме. Справа
даны числа заполнения оболочек.
в соответствующей оболочке, тем выше лежит его уровень энергии. Ядро с
заданным Z присоединяет электроны в порядке уменьшения прочности их связи:
сначала два электрона Is, затем два электрона 2s, шесть электронов 2р и
т. д. в соответствии со схемой рис. 5. Это определяет э л е к т р о н н
ы е к о н ф и г у р а ц и и, т. е. распределения электронов по оболочкам,
для ионов и нейтрального А. данного элемента. Напр., для азота (Z = 7)
получаются электронные конфигурации (число электронов в данной оболочке
указывается индексом справа сверху).
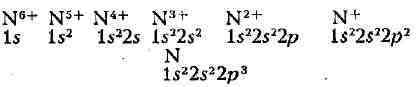
конфигурации, как и ионы азота, имеют нейтральные атомы последовательных
элементов в пе-риодич. системе, обладающие тем же числом электронов: Н,
Не, Li, Be, В, С (z = 1,2,3,4,5,6). Периодичность в свойствах элементов
определяется сходством внешних электронных оболочек А. Напр., нейтральные
А. Р, As, Sb, Bi (Z = 15, 33, 51, 83) имеют по три р-элект-рона во внешней
электронной оболочке подобно А. N и схожи с ним по химическим и многим
физ. свойствам.
электронных эболочек необходимо учитывать, что, начиная с n=4, электроны
с меньшим l, но 5бльшим п, связываются прочнее, чем электроны с большим
l, но меньшим n, напр. электроны As связаны прочнее, чем электроны 3d.Это
отражает рис. 5, показывающий расположение уровней энергии, соответствующее
действительному порядку (несколько схематизированному) заполнения электронных
оболочек для последовательных элементов в периодической системе элементов
Д. И. Менделеева. Числа, стоящие справа у скобок, определяют числа элементов
в периодах этой системы, заканчивающихся атомами инертных газов с внешними
оболочками типа np6 (n=2, 3, 4, 5, 6) для Ne, Аг, Кг, Хе, Rn
(Z = 10, 18, 36, 54, 86). У р о в н и
э н е р г и и
с л о жн ы х а т
о м о в. Каждый А. характеризуется н о р м а л ь н о й электронной конфигурацией,
получающейся, когда все электроны в А. связываются наиболее прочно, и возбуждёнными
электронными конфигурациями, когда один или неск. электронов связаны более
слабо - находятся на более высоких уровнях энергии. Напр., для А. гелия
наряду с нормальной электронной конфигурацией Is2 возможны возбуждённые:
15 2s, Is 2р, ... (возбуждён один электрон), 2s2, 2s2p, ...
(возбуждены оба электрона). Определённой электронной конфигурации соответствует
один уровень энергии А. в целом, если электронные оболочки целиком заполнены
(напр., нормальная конфигурация А. Ne Is2 2s2 In6),
и ряд уровней энергии, если имеются частично заполненные оболочки (напр.,
нормальная конфигурация Л. N Is2 2s2 2p3,
для к-рой оболочка 2р заполнена как раз наполовину). При наличии частично
заполненных d- и f-оболочек число уровней энергии, соответствующих каждой
конфигурации, может достигать многих сотен, так что схема уровней энергии
А. с частично заполненными внешними оболочками получается очень сложной.
Основным уровнем энергии А. является самый нижний уровень нормальной электронной
конфигурации.