Общая характеристика строения
атома.
А. состоит из тяжёлого ядра, обладающего положительным электрич. зарядом,
и окружающих его лёгких электронов с отрицательными электрич. зарядами,
образующих электронные оболочки <А. Размеры А. в целом определяются
размерами его электронной оболочки и велики по сравнению с размерами ядра
А. Характерные порядки размеров:
|
|
Линейные
размеры |
Площадь*
|
Объём
|
|
Атом
|
10-8
см |
10-16
см2 |
10-24
см3 |
|
Ядро
|
10-1,2
см |
10-21
см2 |
10-36
см3 |
|
Отношение
|
104
|
108
|
1012
|
|
*
Поперечное сечение. |
|||
Электронные оболочки А. не
имеют строго определённой границы; значения размеров А. в большей или меньшей
степени зависят от способов их определения и весьма разнообразны (см. Атомные
радиусы).
Заряд ядра - осн. характеристика
А., обусловливающая его принадлежность определённому элементу. Заряд ядра
всегда является целым кратным элементарного положительного электрич. заряда
е, равного по абс. значению заряду электрона -е. Заряд ядра равен + Ze,
где Z - порядковый номер (атомный номер). 2 = 1, 2, 3, 4,... для А. последовательных
элементов в периодической системе элементов Менделеева, т. е. для атомов
Н, Не, Li, Be, ... В не й-тральном А. ядро с зарядом +Ze удерживает Z электронов
с общим зарядом -Ze и полный заряд А. равен нулю; в положительном ионе
- А., потерявшем k электронов (ионизованном А.), остаётся Z-k электронов
(k =1,2, 3, ...-кратность ионизации) и его заряд равен +ke; в отрицательном
ионе - А., присоединившем k электронов,- содержится Z + k электронов, и
его заряд равен -ke. Для положит. иона макс. значение k=Z (такой ион потерял
все свои электроны и состоит из "голого" ядра); для отрицательного свободного
иона fe = l; для связанных А. возможно образование отрицат. ионов с k>l
(в растворах, комплексных соединениях и ионных кристаллах). Говоря об А.
определённого элемента, подразумевают как нейтральные А., так и ионы этого
элемента. Но иногда под А. понимают нейтральный А., в противоположность
ионам. Положительные и отрицат. ионы при написании отличают от нейтрального
А. индексом k+ и k-, напр. О обозначает нейтральный А. кислорода (Z=8),
O<+, О2+(или О++), О3+,...,
О8+- его положит, ионы, О- , О2- (или
О- ) - его отрицат. ионы. Совокупность нейтрального А. и ионов
др. элементов с тем же числом электронов образует изоэлектронный ряд. Простейший
такой ряд начинается с А. водорода: H,He+,Li2+, Be3+,...;
члены этого ряда состоят из ядра и одного электрона.
Порядок значений зарядов
ядер различных А. был определён англ. физиком Э. Резерфордом в его первонач.
опытах по рассеянию альфа-частиц (1911). Значения Z были надёжно установлены
англ, физиком Г. Мозли (1913-14) на основе изучения рентгеновских спектров
последовательных элементов в периодич. системе. Кратность заряда ядра А.
элементарному заряду е получила объяснение, исходя из представлений о строении
ядра: Z равно числу протонов в ядре, протон имеет заряд +е, и полный заряд
ядра равен сумме зарядов всех Z протонов, т. е. +Ze.
Масса атома возрастает с
увеличением Z. Масса ядра А. приближённо пропорциональна массовому числу
А -общему числу протонов и нейтронов в ядре. Масса электрона (0,91 • 10-27
г) значительно меньше (примерно в 1840 раз) массы . протона или нейтрона
(1,67-10-24 г), и поэтому масса А. в целом определяется в основном
массой его ядра.
А. данного элемента могут
отличаться массой ядра (число протонов Z постоянно, число нейтронов А-Z
может меняться); такие разновидности А. одного и того же элемента наз.
изотопами. Различие массы ядра почти не сказывается на строении их электронных
оболочек, зависящем от заряда ядра Z. Химические и большинство физ. свойств
(оптич., электрические, магнитные), определяемые строением электронных
оболочек, одинаковы или очень близки для всех изотопов данного элемента.
Наибольшие отличия в свойствах (и з о т о п и ч е с к и е э ф ф е к т ы)
получаются для изотопов водорода (Z = l) из-за большой разницы в массах
обычного лёгкого А. водорода (А=1), А. дейтерия (А =2) и А. трития (А=3).
Масса А. приближённо равна
массовому числу А и изменяется от 1,67-10-24г для самого лёгкого
А. водорода (основного изотопа: Z = 1,A = 1) до примерно 4-10-22г
для самых тяжёлых А. трансурановых элементов (Z = 100, А=250).
Наиболее точные значения
Э н е р г и я
В простейшем случае А. водорода
Т = 1 / Полная внутренняя энергия
Существование стационарных
товой системы, состоящей
Каждому из этих "дозволенных"
Графически возможные дискретные
Квантование энергии А. является
А
Б
В
Г
Д
Е
Ё
Ж
З
И
Й
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Ш
Щ
Ъ
Ы
Ь
Э
Ю
Я
масс А. могут быть определены методами масс-спектроскопии. Масса А. не
равна в точности сумме массы ядра и масс электронов, а несколько меньше
- на дефект массы AM = W/c2, где W - энергия образования А.
из ядра и электронов, а с - скорость света. Эта поправка - порядка массы
одного электрона т
а т о м а
и е ё
к в а н т о в а н и е. Благодаря малым размерам и большой массе ядра его
можно приближённо считать точечным и покоящимся в центре масс А. (общий
центр масс ядра и электронов находится вблизи ядра, а скорость движения
ядра относительно центра масс А. мала по сравнению со скоростями движения
электронов). Соответственно А. можно рассматривать как систему, в к-рой
N электронов с зарядами -е движутся вокруг неподвижного притягивающего
центра. Движение электронов в А. происходит в ограниченном объёме - оно
является связанным. Полная внутренняя энергия А. Е равна сумме кинетич.
энергий всех электронов Т и потенциальной энергии U - энергии притяжения
их ядром и отталкивания их друг от друга (э л е к т ро с т а т и ч е с
к о й э н е р г и и взаимодействия электрич. зарядов ядра и электронов,
согласно закону Кулона).
один электрон с зарядом -е движется вокруг неподвижного центра с зарядом
+е. В этом случае, согласно классич. механике, кинетич. энергия
= р2/2т, (1) где т - масса, v - скорость, p=mv - количество
движения (импульс) электрона. Потенциальная энергия (сводящаяся к энергии
притяжения электрона ядром) U = U(r)=-e2/r (2) и зависит только
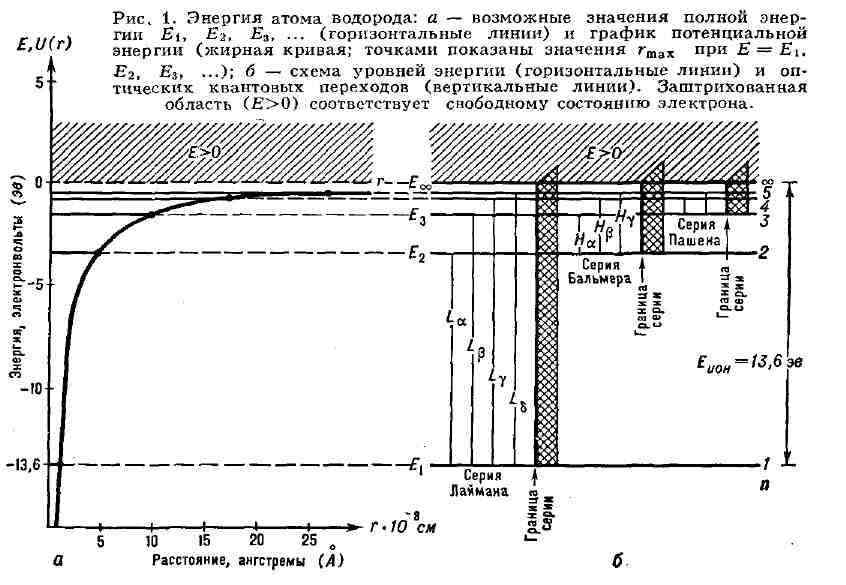
от расстояния r электрона от ядра. Графически функция U(r) изображается
кривой (рис. 1, я), неограниченно убывающей при уменьшении r, т. е. при
приближении электрона к ядру. Значение U (r) на бесконечности принято за
нуль. При отрицат. значениях полной энергии E=Т+U<0 движение электрона
является связанным: оно ограничено в пространстве значениями r = r
с энергией E=T = 1/
ионизованному А. водорода Н+. Нейтральный А. водорода Н представляет,
т. о., систему, состоящую из ядра и электрона в связанном состоянии с энергией
Е<0.
А. Е является его основной характеристикой как квантовой системы - системы,
подчиняющейся квантовым законам (см. Квантовая механика). Как показывает
огромный экспериментальный материал (см., напр., франка - Герца опыт),
А. может длительно находиться лишь в состояниях с определённой энергией
- стационарных (неизменных во времени) состояниях.
состояний - один из основных законов физики микроскопич. явлений - квантовой
физики. Внутренняя энергия к в а н-
из связанных микрочастиц (такой системой и является А.), может принимать
одно из дискретного (прерывного) ряда значений
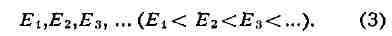
значений энергии соответствует одно или несколько стационарных квантовых
состояний движения. Промежуточными значениями энергии (напр., лежащими
между E
а нахождение возможных значений энергии наз. квантованием энергии. Любое
изменение энергии Е связано с квантовым (скачкообразным) п е-р е х о д
о м системы из одного стационарного квантового состояния в другое (см.
ниже).
значения энергии (3) А. можно изобразить, по аналогии с потенциальной энергией
тела, поднятого на различные высоты (на различные уровни), в виде схемы
уровней энергии, где каждому значению энергии соответствует прямая, проведённая
на высоте E
лишь определённые ступеньки, соединённые горизонтальным пунктиром с уровнями
схемы на рис. 1, б). Самый нижний уровень Ei, соответствующий наименьшей
возможной энергии системы, наз. основным, а все остальные (Ei>Ei, i=2,3,4,...)-
возбуждёнными, т. к. для перехода на них (перехода в соответствующие стационарные
в о з б у ж д ё н н ы е состояния из стационарного о с н о вн о г о с о
с т о я н и я) необходимо возбудить систему - сообщить ей извне энергию
Ei-Ei.
следствием волновых свойств электронов. Нельзя считать, что электрон в
А. движется как материальная точка по определённой траектории, согласно
законам классич. механики. Эти законы справедливы лишь для частиц большой
массы (макрочастиц), а для электрона, как микрочастицы, необходимо учитывать,наряду
с его корпускулярными свойствами (свойствами частицы), и его волновые свойства.
Согласно квантовой механике, движению микрочастицы массы т со скоростью
v соответствует длина волны L=h/mv, где h - Планка постоянная. Для электрона
в А. L