АКТИВИРОВАННЫЙ КОМПЛЕКС
группировка атомов в решающий момент элементарного акта хим.
реакции. Понятием об А. к. широко пользуются в теории скоростей хим. реакций.
Протекание элементарного акта может быть рассмотрено на примере газовой
бимолекулярной реакции образования йодистого водорода из водорода и паров
иода:
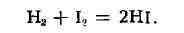
(1)
Как показывает
Переход от
расположение
Энергетич.
Задавшись нек-рым
Поскольку интервал
1 - начальное
Уравнение (3)
Исходные понятия
Сопоставление
Лит.: ГлесстонС.,
М. И. Тёмкин.
А
Б
В
Г
Д
Е
Ё
Ж
З
И
Й
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Ш
Щ
Ъ
Ы
Ь
Э
Ю
Я
квантовомеханич. теория, при сближении молекул Н
от друга с силой, быстро растущей при уменьшении расстояния. Подавляющее
большинство столкновений молекул Н
оказывается недостаточной для преодоления отталкивания. У нек-рой, весьма
малой, доли молекул интенсивность теплового движения случайно много больше
средней; этим создаётся возможность настолько тесного сближения молекул
Н
молекулы HI отталкиваются друг от друга и поэтому расходятся, чем завершается
элементарный акт реакции.
расположения связей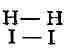 к расположению происходит не
к расположению происходит не
внезапно, а постепенно: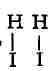 по мере сближения
по мере сближения
молекул Н
Н-I от Н-I в момент, когда новое расположение связей начинает превалировать
над старым. Таким образом, в ходе элементарного акта возникает конфигурация
атомов, являющаяся критической в том смысле, что если она достигнута, то
дальнейшее движение атомов происходит беспрепятственно, не требуя запаса
энергии. Совокупность атомов в этой конфигурации и наз. "активированным
комплексом" (Г. Эйринг, США, 1935) или "переходным состоянием" (М. Г. Эванс
и М. Поляки, Англия, 1935). Для обратной реакции
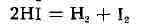
(2)
атомов в А. к. будет таким же, как и для прямой реакции (1), но направления
движения атомов в активированных комплексах реакций (1) и (2) взаимно противоположны.
соотношения при элементарном акте реакции можно схематически представить
с помощью графика, на к-ром потенциальная энергия реагирующей системы U
изображена как функция т. н. реакционной координаты х, описывающей взаимное
расположение атомов.
весьма малым интервалом дельта x (рис.) и считая, что конфигурация атомов
отвечает А. к., если координата х имеет значение, лежащее в пределах этого
интервала, можно ввести понятия - концентрация активированных комплексов
прямой реакции в данной реагирующей системе с+ и их время жизни т. За время
т в единице объёма происходит с+ актов прямой реакции. Т. к. скорость прямой
реакции r+ есть число соответствующих актов реакции в единице объёма в
единицу времени, то
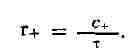
(3)
дельта
x мал, то и с+ и т пропорциональны дельта x, так что их отношение не зависит
от значения произвольно выбранной величины дельта x. Величины с+ и т вычисляются
методами статистич. механики, при этом используют ряд упрощающих предположений,
из к-рых главным является допущение, что протекание реакции не нарушает
статистически равновесное распределение молекул по состояниям.
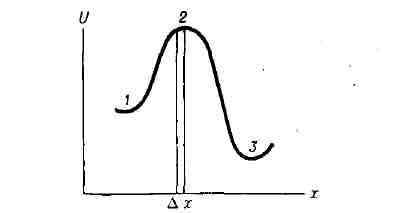
состояние; 2 - активированный комплекс; 3 - конечное состояние.
выражает основную идею теоретич. трактовки скоростей реакций на основе
концепции А. к. Оно не только позволяет судить о зависимости скорости реакции
от концентраций веществ - участников реакции, от темп-ры и др. факторов,
но устанавливает абсолютное значение скорости. Поэтому метод А. к. часто
называют теорией абсолютных скоростей реакций. В нек-рых сравнительно немногочисленных
реакциях перестройка хим. связей происходит затруднённо, так что достижение
конфигурации А. к. ещё не гарантирует осуществление акта реакции. Чтобы
учесть существование таких реакций, называемых неадиабатными, в правую
часть равенства (3) вводят добавочный множитель, "коэффициент прохождения"
или "трансмиссионный коэффициент"; в случае неадиабатных реакций он много
меньше единицы.
метода А. к. были разъяснены выше на примере гомогенной газовой реакции,
но метод применяют и к скоростям реакций в растворах, гетерогенно-каталитич.
реакций и вообще к вычислению скоростей во всех случаях, когда превращение
связано с необходимостью случайного концент-рирования энергии теплового
движения в количестве, значительно превышающем среднюю энергию молекул
при данной темп-ре.
теории абсолютных скоростей реакций с опытными данными, как и теоретич.
анализ её предпосылок, показывает, что эта теория, будучи не вполне точной,
вместе с тем является удачным приближением, ценным своей простотой.
Лейдлер К., Эйринг Г., Теория абсолютных скоростей реакции, пер. с англ.,
М., 1948.